Moderna anunció que su vacuna contra la variante sudafricana del COVID-19 está lista para ser probada
24 febrero 21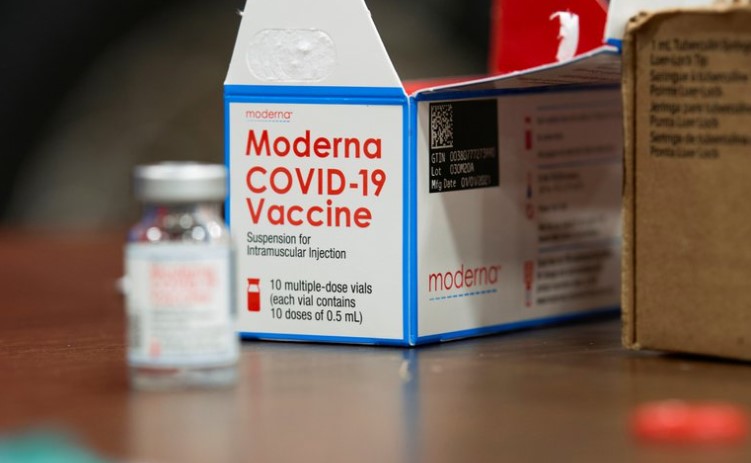
Por Infobae
El laboratorio estadounidense Moderna informó este miércoles que su nueva vacuna desarrollada para combatir la variante sudafricana del COVID-19 fue enviada a los Institutos Nacionales de Salud de EEUU para ser probada.
“Esperamos con ansias el inicio del ensayo clínico” de fase 1, dijo el director ejecutivo de la compañía de biotecnología, Stephane Bancel.
“Mientras buscamos derrotar al COVID-19, debemos estar atentos y ser proactivos ante el surgimiento de nuevas variantes del SARS-CoV-2. Aprovechando la flexibilidad de nuestra plataforma de ARNm, nos estamos moviendo rápidamente para probar las actualizaciones de las vacunas que abordan las variantes emergentes del virus”, añadió Bancel.
En un estudio publicado la semana pasada, Moderna mostró que la sangre de las personas que recibieron la vacuna actual posee anticuerpos neutralizantes contra las principales variantes del COVID-19. Pero solo una sexta parte de los anticuerpos protegían contra la variante B.1.351 del virus, que se originó en Sudáfrica y que es el objetivo de su nueva vacuna.
No está claro si ese bajo nivel de anticuerpos es suficiente para proteger a las personas contra casos sintomáticos o graves de COVID-19 de esta nueva variante.
Es por eso que “por precaución” -dijo la compañía en un comunicado de prensa publicado el miércoles- ha comenzado a trabajar en dos posibles estrategias contra la variante: dar a las personas una dosis de refuerzo de la vacuna original para aumentar los niveles de anticuerpos, y desarrollar dos vacunas específicas para variantes. que podrían suministrarse en lugar de la original.
Además, la compañía aclara que se compromete a realizar tantas actualizaciones de su vacuna como sea necesario “hasta que la pandemia esté bajo control”.
Moderna, que fabrica una de las dos vacunas autorizadas por la FDA en EEUU dijo que ha producido suficiente de su vacuna específica contra la variante sudafricana, llamada mRNA-1273.351, para comenzar a probarla en personas.
Cualquier cambio en la fabricación de las vacunas, incluso aquellos que se hagan para combatir las nuevas variantes del virus, deberá ser aprobado por la Administración de Alimentos y Medicamentos de EEUU, no será el mismo proceso de autorización que tenían para sus inyecciones originales.
El Instituto Nacional de Alergias y Enfermedades Infecciosas colaborará con los estudios clínicos para comprobar si el ARNm-1273.351 puede aumentar la inmunidad contra la variante. En su anuncio del miércoles, la compañía dijo que ya ha enviado suficientes dosis de esta variante específica de vacuna necesarias para las pruebas.
Otras compañías de vacunas contra el COVID-19, como Pfizer-BioNTech, Novavax, Johnson & Johnson y AstraZeneca-Oxford University, también han dicho que están trabajando en nuevas versiones de sus vacunas o refuerzos para aumentar su protección.